L'atome ne peut pas rester dans son état isolé. Il va pègre un ou plusieurs électrons pour devenir ion, ou se mettre avec les autres atomes pour former les molécules.
Les molécules
Les atomes se relient par les liaisons dites covalente ou de covalence. Une liaison covalente est la mise en commun d'un doublé d'électron par 2 atomes, exemple: molécule de dihydrogène.
On appelle valence d'un élément le nombre de liaison que peut former son atome avec les autres atomes. C'est également le nombre d'électron célibataire de sa couche périphérique.

Dans l'assemblage des atomes ou dans leur transformation, ils respectent la règle de l'octet.
Enoncé
Dans toutes transformation l'atome tend à saturer sa couche externe à 8 électrons sauf le cas de l'hydrogène qui sature sa couche externe à 2 électrons.
La molécule est un assemblage d'atome électriquement neutre lié entre eux par des liaisons covalentes ou de covalence. L'atomicité d'une molécule représente le nombre d'atome qu'elle renferme.
Représentation d'une molécule
Formule brute
La formule brute d'une molécule nous permet de savoir le genre et le nombre d'atome qu'elle contient. Pour l'écrire on juxtapose les atomes, chaque atome porte un indice en bas et à droite il représente son nombre dans la molécule.
Exemple:
molécule d'eau H2O
molécule de dioxyde de carbone CO2
molécule de chlorure d'hydrogène Hcl
molécule d'éthanol C2H6O
La formule brute ne nous renseigne pas sur la disposition spatiale des atomes sur les distances inter atomiques ni sur les angles valenciennes ou angles de liaison. Pour ce fait nous allons utiliser la représentation de LEWIS qui nous donne tous ces renseignements c'est-à-dire la stéréochimie de la molécule.
Représentation de LEWIS de la molécule
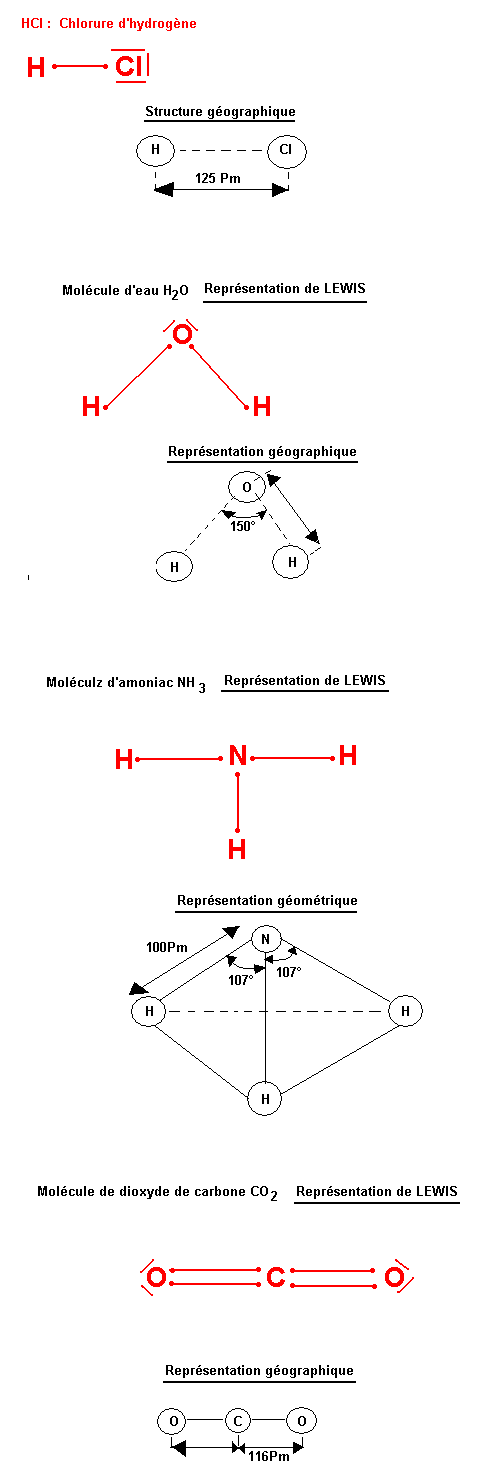
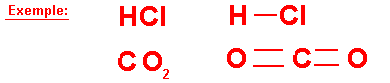
Les ions
Un ion est un atome ou un groupe d'atome qui a perdu ou gagné un ou plusieurs électrons.
Formule d'ions
Exemple: le sodium
11Na
K2L8M1
S'il perd un électron pour avoir sa couche externe saturée, il devient ion sodium.
Na → e + N+a
N+a est un ion sodium, c'est un ion positif.
17Cl
K2L8M7
il gagne un électron pour saturer sa couche externe.
Cl + e → Cl-
Cl- est l'ion chlorure c'est un ion négatif.
Il existe des ions poly-atomiques.
Exemple:
- H3O+ ion hydronium
- OH- ion hydroxyde
- SO2-4 ion sulfate
- NO-3 ion nitrate
- NH-4 ion ammonium
On dira qu'un élément est électropositif si sont atome a tendance à pègre des électrons, exemple: Na; Cu; Fe; Zn.
Un élément est électronégatif si sont atome a tendance à gagner des électrons, exemple: O; Cl; F; Br.
